Las hormonas vegetales, también conocidas como fitohormonas, son compuestos químicos que las plantas producen de forma natural para regular su crecimiento, desarrollo y respuesta a los estímulos ambientales [2]. Estas hormonas son esenciales para coordinar los diversos procesos fisiológicos de las plantas, como la germinación de las semillas, el crecimiento de las raíces, el alargamiento del tallo, la senescencia de las hojas, la maduración de los frutos y las respuestas al estrés [3]–[5].
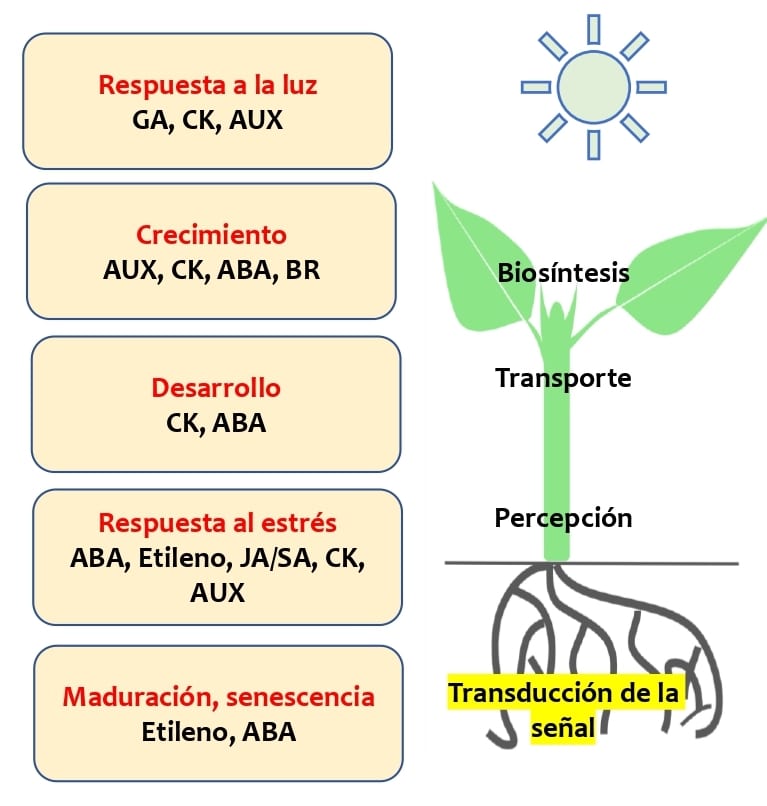
Figura 1: las fitohormonas actúan localmente o son transportadas desde el tejido de origen a los tejidos donde ejercen sus actividades. En este proceso, la interacción específica entre las hormonas vegetales y los receptores son cruciales para la transducción de señales [1]. Las fitohormonas se identifican en cinco clases principales: ácido abscísico (ABA), auxinas (AUX), citoquininas (CK), etileno y giberelinas (GA). Posteriormente los brasinoesteroides (BR), jasmonatos (JA), ácido salicílico (SA) y estrigolactonas (SL) también se consideraron como las principales hormonas vegetales.
Son producidos por varias partes de la planta, como las raíces, tallos, hojas, flores y semillas, y son transportados a diferentes partes de la planta donde tienen efectos específicos. Las funciones relativas de las hormonas vegetales no están restringidas a una etapa en particular, y una red compleja de más de una hormona vegetal está involucrada en el control de varios aspectos, como ejemplo el desarrollo de la fruta [4]. La evidencia sugiere una modulación en los niveles de AUX, CK, GA, etileno, poliaminas (PA) y BR en el cuajado; AUX, GA y BR en el crecimiento del fruto; AUX, ABA, PA durante la maduración del fruto; CK, BR, JA, óxido nítrico (NO) y SA durante la maduración de la fruta [4]. Las fitohormonas (CK, ABA, AUX, Etileno, BR, SL, JA y SA) son los actores clave que regulan varias vías de señalización en respuesta al estrés por nitrógeno y modulan la arquitectura del sistema radicular [6].
¿Sabías que existen microorganismos que modulan respuestas en la planta a través de las hormonas vegetales?
Las plantas crean asociaciones con hongos. Durante los pasos presimbióticos, las raíces de las plantas exudan estrigolactonas (SL) que estimulan la germinación de esporas de hongos y la ramificación de hifas, y promueven el inicio de la simbiosis. En etapas posteriores, diferentes clases de hormonas vegetales pueden actuar como reguladores positivos (AUX, BR, ABA) o negativos (SA, GA) de la interacción. En el hongo micorrízico arbuscular Rhizophagus irregularis se detectó la presencia de una citoquinina (isopentenil adenosina) y una auxina (ácido indolacético). Además, se identificó una giberelina (GA4) en extractos de esporas. R. irregularis produce etileno a partir de la metionina y la vía del ácido α-ceto γ-metiltiobutírico. Estos resultados destacan la posibilidad de que los hongos MA utilicen fitohormonas para interactuar con sus plantas hospedantes o para regular su propio desarrollo [8].
Algunas funciones de las fitohormonas:
Auxinas: esta hormona es responsable de promover el alargamiento y la diferenciación celular, controlar la dominancia apical y regular el fototropismo y el gravitropismo. Puede inducir el alargamiento de entrenudos al regular la producción de GA en arveja y GA puede regular el alargamiento de entrenudos por síntesis y transporte de AUX en Arabidopsis. Tanto AUX como GA pueden inducir el alargamiento celular mediante la activación de proteínas y enzimas estructurales de la pared celular, como la expansina (EXP), la endotransglucosidasa/hidrolasa de xiloglucano (XTH) y la pectinesterasa (PME), para alterar las interacciones con los polímeros de la pared celular. En tabaco (Nicotiana tabacum L) y col (Brassica spp.) se ha reportado también esta interacción entre AUX y GA [9]. En tomate (S. lycopersicum), la abscisión de órganos (ejemplo: hojas, pedicelo) está regulada por AUX, los cambios en el gradiente de auxina a través de la zona de abscisión son el principal determinante del inicio de la abscisión, este proceso es concomitante entre AUX y etileno [10].
Giberelinas: Estas hormonas estimulan el alargamiento de las células, el crecimiento del tallo y la germinación de las semillas. Las giberelinas también juegan un papel importante en el desarrollo floral de las plantas, estimulan la formación de flores y controlando la maduración de los frutos. Las bajas temperaturas y GA inducen la floración en col china (Brassica spp.) [11]. Como se muestra en la figura 2, GA puede afectar la dormancia de los brotes en las plantas. Algunas plantas necesitan un período de dormancia para sobrevivir durante el invierno, GA puede ayudar a regular este proceso. Además, promueve la elongación de las hojas: GA estimula la elongación de las hojas, lo que permite una mayor captación de luz solar y un mejor crecimiento de la planta.
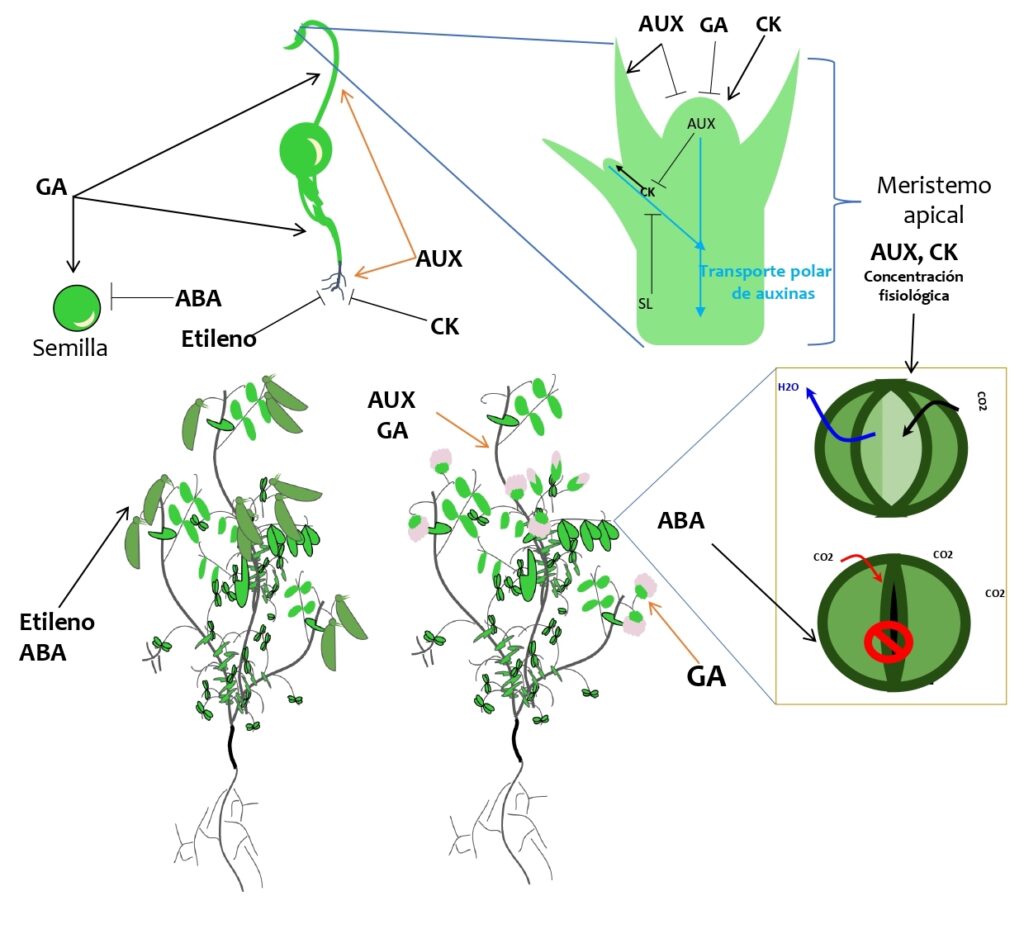
Figura 2: algunas funciones de las hormonas vegetales en el crecimiento y desarrollo de las plantas. Las giberelinas (GA) promueven la germinación de la semilla, el desarrollo de la raíz, la elongación del tallo y la floración; el ácido abscísico (ABA) la dormancia de la semilla, cierre de estomas, maduración de frutos, especialmente no climatéricos como uva y fresa [3], [12]; las auxinas (AUX) promueven el desarrollo de raíces, la expansión celular, la dominancia apical, el desarrollo de frutos, entre muchas otras funciones; el etileno está relacionado con respuestas al estrés y la maduración de frutos; las citoquininas (CK) promueven la división celular, retardan el envejecimiento y la maduración, promueven el desarrollo de brotes laterales. Una de las múltiples funciones que tienen las estrigolactonas (SL) en la planta es bloquear el flujo de auxinas de brotes laterales y de esta forma contribuyen con la dominancia apical. (┴) denota la inhibición de algún proceso, mientras que (→) denota que la hormona promueve algún proceso. Modelo elaborado por Green Crop a partir de datos obtenidos en: Trends In Plant Science. https://www.cell.com/trends/plant-science/home.
Citoquininas: esta hormona promueve la división celular y retrasa la senescencia, lo que resulta en un mayor crecimiento y desarrollo de las plantas. Existe evidencia que demuestra que las citoquininas son reguladores complementarios de la adquisición y distribución de nutrientes dentro de la planta en respuesta a su entorno [6]. Las plantas leguminosas crean asociaciones con bacterias fijadoras de nitrógeno, forman y mantienen nódulos simbióticos que les permitan equilibrar la simbiosis y el crecimiento de la planta. En soya (Glicyne max) CK regula la homeostasis de la nodulación, aunque el mecanismo no se conoce completamente. Una proteína llamada GmRR11d atenúa la nodulación y la activación de la respuesta de CK es esencial para la regulación sistémica de la nodulación; de esta forma las plantas equilibran los costos de carbono entre el crecimiento y la nodulación [13].
Ácido abscísico (ABA): esta hormona participa en la regulación del cierre estomático, lenticelas y en el control de la respuesta de la planta al estrés abiótico como la sequía, la sal y el frío [14]–[16]. Controla también la latencia y la germinación de la semilla, la senescencia, el crecimiento y desarrollo.
Etileno: involucrada en la maduración y la senescencia de la fruta. Promueve la producción de enzimas que descomponen los pigmentos y el almidón en la fruta, lo que puede cambiar su color y sabor. Además, el etileno puede estimular la producción de otras hormonas como las auxinas para ayudar a la regulación del crecimiento y el desarrollo de la planta. Controla el crecimiento de las plantas y las respuestas al estrés. La aclimatación al estrés mediada por etileno incluye, entre otros, el rápido alargamiento de los entrenudos de arroz en respuesta a inundaciones, tolerancia a la sal, tolerancia a metales pesados y cambios morfológicos en las raíces en respuesta a la deficiencia de nutrientes [17].
Jasmonatos: estas hormonas están involucradas en la regulación de las respuestas de defensa de las plantas al estrés biótico, como la depredación de insectos y la infección por patógenos. Se sabe que el JA afecta la germinación de las semillas, la floración, la formación de frutos y la senescencia de las hojas. Sin embargo, el papel más conocido del JA es su función en la defensa de las plantas contra los herbívoros y patógenos. Cuando una planta es atacada por un insecto u otro herbívoro, las células de la planta liberan el JA, que actúa como una señal para alertar a las células circundantes de la planta para prepararse para la defensa. Esto puede incluir la producción de compuestos tóxicos o la activación de mecanismos de defensa enzimáticos [18].
Ácido salicílico (SA): el SA se produce en las plantas en respuesta a una amplia variedad de señales ambientales, incluyendo el ataque de patógenos, el estrés por sequía, la exposición a la luz ultravioleta y la exposición a ciertos productos químicos. Una vez producido, el SA se transloca a otras partes de la planta y desencadena una serie de respuestas adaptativas como fitoalexinas y péptidos antimicrobianos [18]. Se cree que el SA juega un papel en la regulación del crecimiento de las raíces, la floración y la senescencia de las hojas. También se ha sugerido que el SA puede mejorar la tolerancia de las plantas al estrés abiótico, como la sequía y la salinidad.
Brasinosteroides: uno de los efectos más conocidos de los brasinosteroides es su capacidad para promover el crecimiento celular y la elongación de los tallos y las hojas, BR mejora el tamaño de grano en arroz [19]. Los estudios han demostrado que los brasinosteroides actúan en parte a través de la activación de la síntesis de proteínas y el aumento de la tasa de división celular. También se cree que los brasinosteroides juegan un papel importante en la diferenciación de los tejidos, como la formación de xilema y floema en el desarrollo de la raíz [20], [21].
Estrigolactonas: Las estrigolactonas (SL) son hormonas vegetales derivadas de los carotenoides que controlan la ramificación de los brotes y desarrollo de las raíces. En las plantas con flores, SL tienen funciones duales como hormonas que regulan el crecimiento y el desarrollo, y como moléculas de señalización de la rizosfera que inducen la simbiosis con los hongos micorrícicos arbusculares (AM) [22], [23].
En conclusión, las hormonas son compuestos químicos que regulan una amplia variedad de procesos de crecimiento y desarrollo en las plantas. Además, tienen un papel clave en la respuesta a estímulos ambientales y a la interacción con organismos del suelo como hongos micorrícicos arbusculares, bacterias nitrificantes, patógenos, etc. Cada hormona tiene funciones específicas, pero todas trabajan juntas para mantener el equilibrio en la planta.
¿Quieres conocer más? Contáctanos y uno de nuestros expertos se comunicará muy pronto contigo.
2 respuestas a «¿Qué son las fitohormonas y cómo funcionan?»
Referencias2 respuestas a «¿Qué son las fitohormonas y cómo funcionan?»
[…] la floración, el amarre de frutos y por tanto, el rendimiento. En un artículo anterior del foro: ¿Qué son las fitohormonas y cómo funcionan?, se menciona la función que cumplen estos biorreguladores en la planta. Estas hormonas regulan y […]
Bienvenido a Green Crop.
De acuerdo con tu pregunta sobre ¿Qué regulan las fitohormonas en el cultivo de aguacate? te contamos que esto depende de la etapa de desarrollo del cultivo. En el caso de aguacate durante la floración: Tz (citoquinina) y GA3 (giberelina), regulan el transporte de azúcares hacia el fruto. Una concentración adecuada de estas hormonas reduce el aborto de flores y de frutos. En el artículo se menciona que es más fuerte la influencia de las hormonas sobre el cuajado de frutos de ramas determinadas e indeterminadas que la relación fuente vertedero.
Cuéntanos si tienes alguna otra duda, con gusto podemos asesorarte en nuestra línea de atención al cliente 3113271923. Saludos.
Deja un comentario
[1] S. Hagihara, R. Yamada, K. Itami, and K. U. Torii, “Dissecting plant hormone signaling with synthetic molecules: perspective from the chemists,” Current Opinion in Plant Biology, vol. 47. Elsevier Ltd, pp. 32–37, Feb. 01, 2019. doi: 10.1016/j.pbi.2018.09.002.
[2] Y. Chen, Y. Wang, X. Liang, Y. Zhang, and A. R. Fernie, “Mass spectrometric exploration of phytohormone profiles and signaling networks,” Trends Plant Sci, Dec. 2022, doi: 10.1016/j.tplants.2022.12.006.
[3] P. McAtee, S. Karim, R. Schaffer, and K. David, “A dynamic interplay between phytohormones is required for fruit development, maturation, and ripening,” Frontiers in Plant Science, vol. 4, no. APR. Frontiers Research Foundation, Apr. 17, 2013. doi: 10.3389/fpls.2013.00079.
[4] R. Kumar, A. Khurana, and A. K. Sharma, “Role of plant hormones and their interplay in development and ripening of fleshy fruits,” Journal of Experimental Botany, vol. 65, no. 16. Oxford University Press, pp. 4561–4575, 2014. doi: 10.1093/jxb/eru277.
[5] L. F. Estrada, “Efecto del ácido indol-3-acetico en el enraizado de retoños de piña (Ananas comosus (L.) Merr) en condiciones de campo,” Universidad de Caldas Facultad de Agronomía, Manizales, 1970. Accessed: Feb. 05, 2023. [Online]. Available: https://repository.agrosavia.co/bitstream/handle/20.500.12324/28606/25952_11734.pdf?sequence=1&isAllowed=y
[6] N. Ahmad, Z. Jiang, L. Zhang, I. Hussain, and X. Yang, “Insights on Phytohormonal Crosstalk in Plant Response to Nitrogen Stress: A Focus on Plant Root Growth and Development,” Int J Mol Sci, vol. 24, no. 4, p. 3631, Feb. 2023, doi: 10.3390/ijms24043631.
[7] Y. Lu and J. Xu, “Phytohormones in microalgae: A new opportunity for microalgal biotechnology?,” Trends in Plant Science, vol. 20, no. 5. Elsevier Ltd, pp. 273–282, May 01, 2015. doi: 10.1016/j.tplants.2015.01.006.
[8] S. Pons et al., “Phytohormone production by the arbuscular mycorrhizal fungus Rhizophagus irregularis,” PLoS One, vol. 15, no. 10 October, Oct. 2020, doi: 10.1371/journal.pone.0240886.
[9] E. Kou et al., “Crosstalk between auxin and gibberellin during stalk elongation in flowering Chinese cabbage,” Sci Rep, vol. 11, no. 1, Dec. 2021, doi: 10.1038/s41598-021-83519-z.
[10] X. Dong, C. Ma, T. Xu, M. S. Reid, C. Z. Jiang, and T. Li, “Auxin response and transport during induction of pedicel abscission in tomato,” Hortic Res, vol. 8, no. 1, Dec. 2021, doi: 10.1038/s41438-021-00626-8.
[11] S. wei SONG, Y. ling LEI, X. min HUANG, W. SU, R. yuan CHEN, and Y. wei HAO, “Crosstalk of cold and gibberellin effects on bolting and flowering in flowering Chinese cabbage,” J Integr Agric, vol. 18, no. 5, pp. 992–1000, May 2019, doi: 10.1016/S2095-3119(18)62063-5.
[12] F. Gao, X. Mei, Y. Li, J. Guo, and Y. Shen, “Update on the Roles of Polyamines in Fleshy Fruit Ripening, Senescence, and Quality,” Frontiers in Plant Science, vol. 12. Frontiers Media S.A., Feb. 10, 2021. doi: 10.3389/fpls.2021.610313.
[13] J. Chen et al., “The B-type response regulator GmRR11d mediates systemic inhibition of symbiotic nodulation,” Nat Commun, vol. 13, no. 1, Dec. 2022, doi: 10.1038/s41467-022-35360-9.
[14] X. Tao et al., “Exogenous abscisic acid regulates primary metabolism in postharvest cherry tomato fruit during ripening,” Sci Hortic, vol. 299, Jun. 2022, doi: 10.1016/j.scienta.2022.111008.
[15] S. Tombesi et al., “Stomatal closure is induced by hydraulic signals and maintained by ABA in drought-stressed grapevine,” Sci Rep, vol. 5, Jul. 2015, doi: 10.1038/srep12449.
[16] F. Liu, C. R. Jensen, A. Shahanzari, M. N. Andersen, and S. E. Jacobsen, “ABA regulated stomatal control and photosynthetic water use efficiency of potato (Solanum tuberosum L.) during progressive soil drying,” Plant Science, vol. 168, no. 3, pp. 831–836, Mar. 2005, doi: 10.1016/j.plantsci.2004.10.016.
[17] H. L. Park et al., “Ethylene-triggered subcellular trafficking of CTR1 enhances the response to ethylene gas,” Nat Commun, vol. 14, no. 1, Jan. 2023, doi: 10.1038/s41467-023-35975-6.
[18] L. Liu et al., “Salicylic acid receptors activate jasmonic acid signalling through a non-canonical pathway to promote effector-triggered immunity,” Nat Commun, vol. 7, Oct. 2016, doi: 10.1038/ncomms13099.
[19] R. Che et al., “Control of grain size and rice yield by GL2-mediated brassinosteroid responses,” Nat Plants, vol. 1, Dec. 2015, doi: 10.1038/nplants.2015.195.
[20] J. She et al., “Structural insight into brassinosteroid perception by BRI1,” Nature, vol. 474, no. 7352, pp. 472–477, Jun. 2011, doi: 10.1038/nature10178.
[21] Y. Fridman et al., “The root meristem is shaped by brassinosteroid control of cell geometry,” Nat Plants, vol. 7, no. 11, pp. 1475–1484, Nov. 2021, doi: 10.1038/s41477-021-01014-9.
[22] K. Kodama et al., “An ancestral function of strigolactones as symbiotic rhizosphere signals,” Nat Commun, vol. 13, no. 1, Dec. 2022, doi: 10.1038/s41467-022-31708-3.
[23] E. Xu et al., “Catabolism of strigolactones by a carboxylesterase,” Nat Plants, vol. 7, no. 11, pp. 1495–1504, Nov. 2021, doi: 10.1038/s41477-021-01011-y.

Deja un comentario